HIBRIDACION
Hibridación sp3

Se dice que se produce una hibridación sp3
en el átomo de carbono, cuando sus orbitales 2s,
2px, 2py y 2pz se mezclan o hibridizan formando cuatro orbitales híbridos sp3
.
Estos orbitales híbridos tendrán la misma forma y
la misma energía, por ello se dice, que son equivalentes. Presentan un arreglo geométrico tetraédrico y
sus ángulos de enlace son de 109.5°
La hibridación sp3
en el átomo de carbono, es característica de los alcanos. Los cuatro enlaces formados por el átomo de carbono son enlaces sencillos
(tipo sigma, σ). Podemos concluir que siempre que
el átomo de carbono se una a cuatro átomos iguales
o diferentes, se debe a que presenta hibridación sp3
.
Hibridacion sp2

En este tipo de hibridación se mezclan el orbital 2s y los orbitales 2px y 2py, quedando el orbital
2pz sin hibridizar, formando tres orbitales híbridos sp2
Los tres orbitales híbridos sp2
son usados por el átomo de
carbono para formar tres enlaces sigma (σ) y el orbital pz puro
para formar el enlace pi (π).
La hibridación sp2
es característica de los alquenos, ella
nos permite explicar sus características químicas, su geometría trigonal y los ángulos de
enlace de 120°.
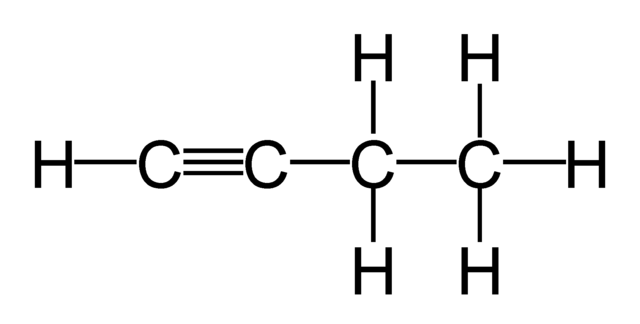
Hibridacion sp
En este tipo de hibridación, se mezclan el orbital 2s con el orbital 2px, quedando los orbitales 2py
y 2pz puros sin hibridizar, formando dos orbitales híbridos sp.
La hibridación sp es característica de los alquinos, ella nos permite explicar sus características químicas, su geometría lineal y los ángulos de enlace de 180°
Podemos concluir que cuando el átomo de carbono forma un triple enlace carbono-carbono,
carbono-nitrógeno o dos enlaces dobles acumulados, utiliza una hibridación sp.
Las siguientes moléculas presentan átomos de carbono con hibridación sp

 Se dice que se produce una hibridación sp3
en el átomo de carbono, cuando sus orbitales 2s,
2px, 2py y 2pz se mezclan o hibridizan formando cuatro orbitales híbridos sp3
.
Se dice que se produce una hibridación sp3
en el átomo de carbono, cuando sus orbitales 2s,
2px, 2py y 2pz se mezclan o hibridizan formando cuatro orbitales híbridos sp3
.  En este tipo de hibridación se mezclan el orbital 2s y los orbitales 2px y 2py, quedando el orbital
2pz sin hibridizar, formando tres orbitales híbridos sp2
En este tipo de hibridación se mezclan el orbital 2s y los orbitales 2px y 2py, quedando el orbital
2pz sin hibridizar, formando tres orbitales híbridos sp2
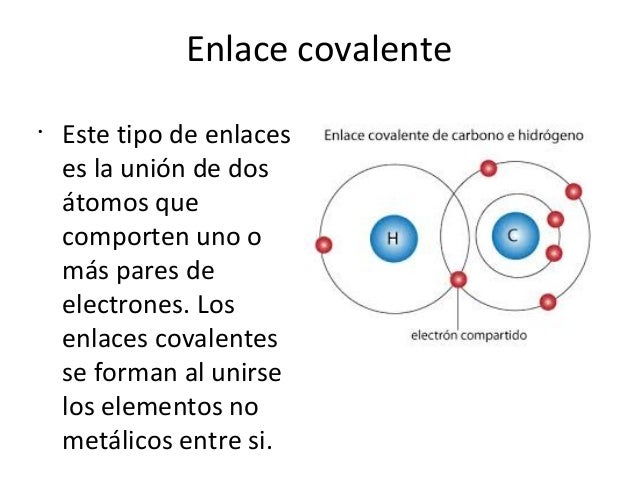 Una de las características de los compuestos del carbono
es el tipo de enlace que en ellos predomina. El enlace covalente es característico de los compuestos del carbono, como
ya lo hemos mencionado. En ellos existen enlaces covalentes simples, dobles o triples. Sin embargo, dependiendo de
la distribución simétrica o asimétrica de los electrones compartidos entre los átomos, estos puede ser de naturaleza no
polar o polar respectivamente.
Una de las características de los compuestos del carbono
es el tipo de enlace que en ellos predomina. El enlace covalente es característico de los compuestos del carbono, como
ya lo hemos mencionado. En ellos existen enlaces covalentes simples, dobles o triples. Sin embargo, dependiendo de
la distribución simétrica o asimétrica de los electrones compartidos entre los átomos, estos puede ser de naturaleza no
polar o polar respectivamente.
 La gran mayoría de los compuestos del carbono son combustibles, sean estos, gaseosos, líquidos o sólidos. Ejemplo de ello: el petróleo, carbón, gas natural, gasolina, diesel, alcohol, éter,
benceno, tetracloruro de carbono, etc. Sin embargo, el CO2
es un compuesto del carbono, pero
de tipo inorgánico que actúa como agente extinguidor del fuego
La gran mayoría de los compuestos del carbono son combustibles, sean estos, gaseosos, líquidos o sólidos. Ejemplo de ello: el petróleo, carbón, gas natural, gasolina, diesel, alcohol, éter,
benceno, tetracloruro de carbono, etc. Sin embargo, el CO2
es un compuesto del carbono, pero
de tipo inorgánico que actúa como agente extinguidor del fuego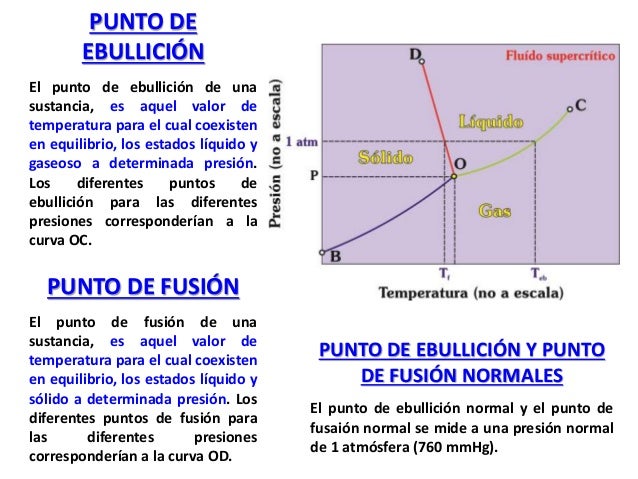 Los compuestos del carbono generalmente presentan puntos de fusión y de ebullición bajos (menores a los 400 °C), a temperaturas más elevadas se descomponen. Por ejemplo, al comparar
los puntos de fusión entre el cloruro de sodio (NaCl) y el etanol, encontramos que el NaCl tiene
un punto de fusión de 800 °C, mientras que el del etanol es de -114.7 °C. Asimismo el punto de
ebullición del alcohol es de 78.5 °C, mientras que el del NaCl es de 1465 °C.
Los compuestos del carbono generalmente presentan puntos de fusión y de ebullición bajos (menores a los 400 °C), a temperaturas más elevadas se descomponen. Por ejemplo, al comparar
los puntos de fusión entre el cloruro de sodio (NaCl) y el etanol, encontramos que el NaCl tiene
un punto de fusión de 800 °C, mientras que el del etanol es de -114.7 °C. Asimismo el punto de
ebullición del alcohol es de 78.5 °C, mientras que el del NaCl es de 1465 °C. La isomería es un fenómeno común en la química del carbono y una más de las razones que
hacen aumentar el número de compuestos del carbono en la naturaleza.
Los compuestos del carbono presentan la propiedad de isomería, característica que permite
que dos o más sustancias tengan el mismo número y tipo de átomos, pero diferentes propiedades físicas y químicas.
Se denominan isómeros a los compuestos que poseen una misma fórmula molecular, pero
diferente fórmula estructural
La isomería es un fenómeno común en la química del carbono y una más de las razones que
hacen aumentar el número de compuestos del carbono en la naturaleza.
Los compuestos del carbono presentan la propiedad de isomería, característica que permite
que dos o más sustancias tengan el mismo número y tipo de átomos, pero diferentes propiedades físicas y químicas.
Se denominan isómeros a los compuestos que poseen una misma fórmula molecular, pero
diferente fórmula estructural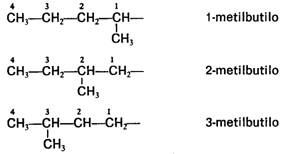




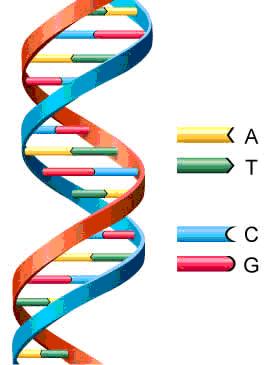 El carbono es un elemento importante y esencial para los seres vivos, forma parte de la molécula
de DAN biomolécula que hace posible la reproducción y preservación de la vida en el planeta
El carbono es un elemento importante y esencial para los seres vivos, forma parte de la molécula
de DAN biomolécula que hace posible la reproducción y preservación de la vida en el planeta