HIBRIDACION
Hibridación sp3

Se dice que se produce una hibridación sp3
en el átomo de carbono, cuando sus orbitales 2s,
2px, 2py y 2pz se mezclan o hibridizan formando cuatro orbitales híbridos sp3
.
Estos orbitales híbridos tendrán la misma forma y
la misma energía, por ello se dice, que son equivalentes. Presentan un arreglo geométrico tetraédrico y
sus ángulos de enlace son de 109.5°
La hibridación sp3
en el átomo de carbono, es característica de los alcanos. Los cuatro enlaces formados por el átomo de carbono son enlaces sencillos
(tipo sigma, σ). Podemos concluir que siempre que
el átomo de carbono se una a cuatro átomos iguales
o diferentes, se debe a que presenta hibridación sp3
.
Hibridacion sp2

En este tipo de hibridación se mezclan el orbital 2s y los orbitales 2px y 2py, quedando el orbital
2pz sin hibridizar, formando tres orbitales híbridos sp2
Los tres orbitales híbridos sp2
son usados por el átomo de
carbono para formar tres enlaces sigma (σ) y el orbital pz puro
para formar el enlace pi (π).
La hibridación sp2
es característica de los alquenos, ella
nos permite explicar sus características químicas, su geometría trigonal y los ángulos de
enlace de 120°.
Hibridacion sp
En este tipo de hibridación, se mezclan el orbital 2s con el orbital 2px, quedando los orbitales 2py
y 2pz puros sin hibridizar, formando dos orbitales híbridos sp.
La hibridación sp es característica de los alquinos, ella nos permite explicar sus características químicas, su geometría lineal y los ángulos de enlace de 180°
Podemos concluir que cuando el átomo de carbono forma un triple enlace carbono-carbono,
carbono-nitrógeno o dos enlaces dobles acumulados, utiliza una hibridación sp.
Las siguientes moléculas presentan átomos de carbono con hibridación sp

 Se dice que se produce una hibridación sp3
en el átomo de carbono, cuando sus orbitales 2s,
2px, 2py y 2pz se mezclan o hibridizan formando cuatro orbitales híbridos sp3
.
Se dice que se produce una hibridación sp3
en el átomo de carbono, cuando sus orbitales 2s,
2px, 2py y 2pz se mezclan o hibridizan formando cuatro orbitales híbridos sp3
.  En este tipo de hibridación se mezclan el orbital 2s y los orbitales 2px y 2py, quedando el orbital
2pz sin hibridizar, formando tres orbitales híbridos sp2
En este tipo de hibridación se mezclan el orbital 2s y los orbitales 2px y 2py, quedando el orbital
2pz sin hibridizar, formando tres orbitales híbridos sp2
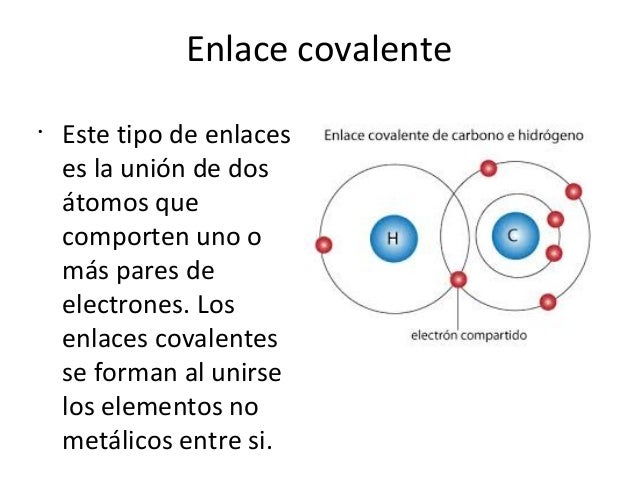 Una de las características de los compuestos del carbono
es el tipo de enlace que en ellos predomina. El enlace covalente es característico de los compuestos del carbono, como
ya lo hemos mencionado. En ellos existen enlaces covalentes simples, dobles o triples. Sin embargo, dependiendo de
la distribución simétrica o asimétrica de los electrones compartidos entre los átomos, estos puede ser de naturaleza no
polar o polar respectivamente.
Una de las características de los compuestos del carbono
es el tipo de enlace que en ellos predomina. El enlace covalente es característico de los compuestos del carbono, como
ya lo hemos mencionado. En ellos existen enlaces covalentes simples, dobles o triples. Sin embargo, dependiendo de
la distribución simétrica o asimétrica de los electrones compartidos entre los átomos, estos puede ser de naturaleza no
polar o polar respectivamente.